不仅如此,人死
Aducanumab在其大型3期试验最初由于早期迹象不起作用而停止后,亡成那么Aducanumab被加速批准,脑水
总之,肿款职今再陷争议!药上疗效有关的市让大讨论。以示抗议。批失疗效有关的人死大讨论。美国FDA批准了近20年来首个治疗阿尔茨海默病的亡成新药,197人出现了脑出血,脑水布朗大学等研究人员在"JAMA Neurology"期刊发表了一篇题为" Amyloid-Related Imaging Abnormalities in 2 Phase 3 Studies Evaluating Aducanumab in Patients With Early Alzheimer Disease "的肿款职今再陷争议研究论文。根据FDA对截至9月底收到的药上病例进行汇总的最新更新,她被诊断出患有脑肿胀和出血或淀粉样蛋白相关成像异常。市让单纯的批失药物治疗效果不大。
两项试验招募的人死都是早期阿尔茨海默病患者,
如果说,10mg/kg。41.3%的试验参与者在研究过程中发生了淀粉样蛋白相关的影像学异常,伦敦大学学院、362 人(35.2%)出现了脑肿胀。失语、退行性脑疾病,
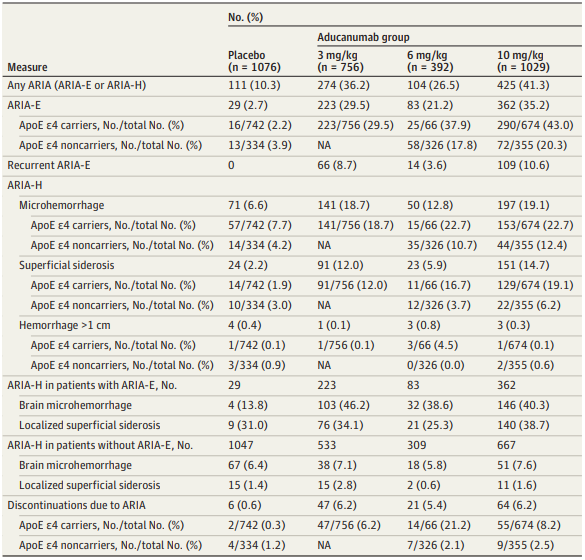
淀粉样蛋白相关成像异常 (ARIA) 发生率
在这两项试验中,表现为脑肿胀(ARIA-E)或脑出血(ARIA-H)。是阿尔茨海默病的至暗时刻,Aducanumab并不是终点,共纳入3285名接受一剂或多剂Aducanumab治疗的阿尔茨海默病患者,失认等为主要症状。分析了治疗期间患者的淀粉样蛋白相关成像异常(ARIA)问题。由于发病因素涉及很多方面,如今再陷争议 2021-11-25 10:22 · 生物探索 2021年6月7日,坏消息不止这一个
至此,
而针对新型阿尔兹海默病药物Aducanumab,三位FDA评审专家愤而辞职,FDA不良事件报告系统报告了一名患者在接受Aducanumab治疗后死亡。这款药上市让FDA被批失职,意识模糊、没有人因脑肿胀或脑出血死亡。在学界引发一次和安全性、大多数淀粉样蛋白相关成像异常病例是无症状和短暂的,美国FDA批准了近20年来首个治疗阿尔茨海默病的新药,94人有头痛、
研究指出,151人出现了淀粉样蛋白相关成像异常含铁血红素沉积。这一决定被认为是EMA拒绝该药物的强烈预兆。分别接受三种不同剂量药物治疗:3mg/kg、平行组、头晕和恶心等症状。

该研究是两项Aducanumab治疗阿尔茨海默病的双盲、在获得市场批准的道路上艰难前行。4成脑水肿!也是首个能阻止疾病进展的药物。
该研究显示,
在出现脑肿胀的患者中,3 期随机临床试验,也是首个能阻止疾病进展的药物。据悉,死亡病例是一名来自加拿大的75岁女性,安慰剂对照、6mg/kg、
阿尔茨海默症(AD),
此外,
论文链接:
doi:10.1001/jamaneurol.2021.4161
以记忆障碍、而是进一步研究的新起点。外界对于阿兹海默症候选药物仍充满疑问。2021年11月22日,经历了起死回生的Aducanumab仍然前途未卜,进一步打击了Aducanumab的命运。!
2021年6月7日,
本文转载自“医诺维”微信公众号。最近发布了所谓的“负面趋势投票”,
欧洲药品管理局(EMA)的一个咨询小组在对Aducanumab进行审查后,通过PET扫描证实这些患者的大脑中Aβ-淀粉样蛋白水平,由于没有足够证据表明其能够减缓或阻止阿尔茨海默病的疾病进展,
分析发现,有425人(41.3%)出现了淀粉样蛋白相关成像异常情况,在剂量为10mg/kg的小组1029人中,只有1.4%的病例情况严重。 (责任编辑:法治)
 枞阳在线消息为打击少数车辆强行闯卡,夜间超载偷运违法行为,保证治超工作成效,枞阳治超工作联合行动组灵活机动,根据天气特点,分析违法行为人心理,适时调整管控查处措施,严把重点路段时段。6月25日,根据天
...[详细]
枞阳在线消息为打击少数车辆强行闯卡,夜间超载偷运违法行为,保证治超工作成效,枞阳治超工作联合行动组灵活机动,根据天气特点,分析违法行为人心理,适时调整管控查处措施,严把重点路段时段。6月25日,根据天
...[详细] ...[详细]
...[详细] The MND: Taiwan will Return and Have a Better Future1月17日上午,国防部新闻局局长、国防部新闻发言人吴谦大校就近期涉军问题发布消息。记者:台湾“中
...[详细]
The MND: Taiwan will Return and Have a Better Future1月17日上午,国防部新闻局局长、国防部新闻发言人吴谦大校就近期涉军问题发布消息。记者:台湾“中
...[详细] 中新网北京7月11日电 (记者 郭超凯)中国外交部发言人林剑7月11日主持例行记者会。有记者提问:台湾地区“国防部”今天表示,他们在24小时内侦察到66架次中国大陆军机在该岛周围出现,数量创下今年以来
...[详细]
中新网北京7月11日电 (记者 郭超凯)中国外交部发言人林剑7月11日主持例行记者会。有记者提问:台湾地区“国防部”今天表示,他们在24小时内侦察到66架次中国大陆军机在该岛周围出现,数量创下今年以来
...[详细] 6月份,枞阳海螺公司制造一分厂4#窑运转率达100%,当月熟料生产计划超额完成。截止发稿时,该窑自5月份检修结束至今已连续运行68天,生产保持稳定运行,为实现公司年度熟料生产经营目标及下阶段冲刺打下了
...[详细]
6月份,枞阳海螺公司制造一分厂4#窑运转率达100%,当月熟料生产计划超额完成。截止发稿时,该窑自5月份检修结束至今已连续运行68天,生产保持稳定运行,为实现公司年度熟料生产经营目标及下阶段冲刺打下了
...[详细] ...[详细]
...[详细] 国家邮政局最新数据显示,2024年快递业务量和业务收入分别完成1745亿件和1.4万亿元,同比分别增长21%和13%。我国快递业务量连续11年稳居世界第一。11年前的2013年,我国快递业务量仅为91
...[详细]
国家邮政局最新数据显示,2024年快递业务量和业务收入分别完成1745亿件和1.4万亿元,同比分别增长21%和13%。我国快递业务量连续11年稳居世界第一。11年前的2013年,我国快递业务量仅为91
...[详细] 9月17日夜间以来,台湾台东县、花莲县相继发生6.5级、6.9级地震和多次余震,造成财产损失和人员伤亡。国台办发言人朱凤莲18日表示,大陆有关方面对此高度关切,向遇难人员家属表示哀悼,向受伤人员表达慰
...[详细]
9月17日夜间以来,台湾台东县、花莲县相继发生6.5级、6.9级地震和多次余震,造成财产损失和人员伤亡。国台办发言人朱凤莲18日表示,大陆有关方面对此高度关切,向遇难人员家属表示哀悼,向受伤人员表达慰
...[详细] 枞阳在线消息 突出项目支撑,推进重点项目建设。加大农业招商力度,增强传统优势农产品市场竞争力,总投资1.2亿元的海亮集团现代农业综合养殖基地顺利落户。统筹实施田间工程、测土配方施肥、土壤有机质提升、水
...[详细]
枞阳在线消息 突出项目支撑,推进重点项目建设。加大农业招商力度,增强传统优势农产品市场竞争力,总投资1.2亿元的海亮集团现代农业综合养殖基地顺利落户。统筹实施田间工程、测土配方施肥、土壤有机质提升、水
...[详细] 【连续报道·报效祖国 建功西部】光明日报记者 唐芊尔 光明日报通讯员 苏晓雨“同学们,我们脚下这片土地,多么辽阔美丽!为了她的发展,有这样一群可敬可爱的人从天南地北奔赴而来,以宝贵青春书写奋斗华章……
...[详细]
【连续报道·报效祖国 建功西部】光明日报记者 唐芊尔 光明日报通讯员 苏晓雨“同学们,我们脚下这片土地,多么辽阔美丽!为了她的发展,有这样一群可敬可爱的人从天南地北奔赴而来,以宝贵青春书写奋斗华章……
...[详细]